Polyethylenimin
| Strukturformel | ||||||||
|---|---|---|---|---|---|---|---|---|
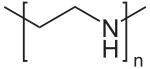
| ||||||||
| Allgemeines | ||||||||
| Name | Polyethylenimin | |||||||
| Andere Namen |
| |||||||
| CAS-Nummer | 9002-98-6 | |||||||
| Monomer | Ethylenimin | |||||||
| Summenformel der Wiederholeinheit | C2H5N | |||||||
| Molare Masse der Wiederholeinheit | 43,07 g·mol−1 | |||||||
| Eigenschaften | ||||||||
| Aggregatzustand |
viskos-flüssig bis fest | |||||||
| Löslichkeit |
wasserlöslich[1] | |||||||
| Sicherheitshinweise | ||||||||
| ||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||
Polyethylenimin (Abk.: PEI[2]) ist formal das Polymerisierungsprodukt seines Monomers Ethylenimin, besser bezeichnet als Aziridin.
Ethylenimin (Aziridin) ist entgegen der Bezeichnung kein Imin, da in ihm der Stickstoff keine Doppelbindung zu einem Kohlenstoffatom aufweist, sondern zwei Einfachbindungen zu zwei verschiedenen C-Atomen und daher ein sekundäres Amin.
Das Monomer stellt einen Heterozyklus der – kleinstmöglichen – Ringgröße 3 dar.[3]
Molekülstruktur
[Bearbeiten | Quelltext bearbeiten]Wenn Ethylenimin durch ringöffnende Polymerisation polymerisiert wird, entsteht allerdings ein stark verzweigtes Polymer-Molekül. Die Aminogruppen werden bei Zugabe von Wasser protoniert und so liegt es in wässriger Lösung als stark basisches Polykation vor.
Mit p-Toluolsulfonsäuremethylester als Initiator lassen sich 2-alkyl-substituierte 2-Oxazoline zu N-substituierten Polyethylenimin polymerisieren. Nach Verseifung entsteht daraus ein lineares Polyethylenimin.[4]
Da es sich um ein Polymer handelt, ist eine Einstufung der Gefahrenklasse nur für eine bestimmte molare Masse und für eine bestimmte Zusammensetzung (hier Anteil primärer, sekundärer und tertiärer Amine[5]) möglich. Generell gilt, dass je höher die molare Masse ist (also in diesem konkreten Fall, je mehr sekundäres Amin vorliegt), desto weniger reizend und gesundheitsschädlich ist das Produkt.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Polyethylenimin wird u. a. als Fällmittel zur Aufbereitung von Zellextrakten genutzt. Hierbei fällt es auf Grund seiner Ladung in erster Linie die hoch negativ geladenen Nukleinsäuren, aber eventuell auch stark saure Proteine (besitzen viele negative Ladungen in Form von Carboxylatgruppen R–COO− auf ihrer Oberfläche) aus. Man kann daher PEI zur Klassentrennung von Nukleinsäuren und Proteinen einsetzen, vor allem weil Nukleinsäuren mit anderen Proteinreinigungsmethoden interferieren könnten. Hochmolekulares PEI wird bei der Papierherstellung als Flockungs- und Retentionsmittel eingesetzt. Auch die Anwendung als Ionenaustauscher in der Wasseraufbereitung ist möglich.[6]
Weitere Einsatzmöglichkeiten bieten sich beispielsweise bei der Transfektion von Nukleinsäuren, wie z. B. Plasmide oder siRNAs in humane oder murine Zellen, sowohl für in vivo als auch in vitro Transfektionen. Die Verwendung dieses synthetischen Polymers ist zudem eine günstige Alternative zu kommerziellen Transfektionsreagentien.[7]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Datenblatt Polyethylenimine, branched bei Sigma-Aldrich, abgerufen am 9. September 2019 (PDF).
- ↑ Anm. PEI steht auch für Polyetherimid(e), eine Gruppe von Kunststoffen
- ↑ Anm. Vergleiche dazu die Molekülstruktur und Namensbildung von Ethylenoxid, das die gleiche Elektronenkonfiguration aufweist.
- ↑ Blandine Brissaul u. a.: Synthesis of Linear Polyethylenimine Derivatives for DNA Transfection. In: Bioconjugate Chem. 14, 2003, S. 581–587.
- ↑ Anm. Primäres Amin = R-NH2, nur eine Valenz des Stickstoffatoms bindet an einen organischen Rest R, usw.
- ↑ Patent EP0925313B1: Unlöslische, nur wenig quellbare Polimerisate mit modifizierten Aminogruppen, Verfahren zu ihrer Herstellung und Verwendung. Angemeldet am 21. August 1997, veröffentlicht am 17. Mai 2000, Anmelder: BASF AG, Erfinder: Jens Utecht, Martin Rübenacker, Claudia Nilz, Rainer Rahm.
- ↑ M. Wirth, P. Fritsche, N. Stojanovic, M. Brandl, S. Jaeckel, R. M. Schmid, D. Saur, G. Schneider: A Simple and Cost-Effective Method to Transfect Small Interfering RNAs Into Pancreatic Cancer Cell Lines Using Polyethylenimine. In: Pancreas. 7. Oktober 2010 (Epub). PMID 20938367.


